Ambicioso, pero… ¿viable? Comentarios sobre Proyecto de Ley 372 de Seguridad Farmacéutica

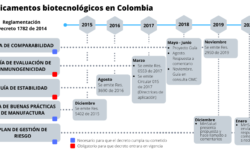
Por: Manuel Machado (autor) y Jennifer Bueno (editora) Mensajes clave El Senador Iván Darío Agudelo está impulsando el Proyecto de Ley 372 que dicta las bases de Investigación y Desarrollo para la “Seguridad Farmacéutica”. El pasado 4 de marzo el congresista convocó a varias instancias a audiencia pública para recibir…