El propósito del presente documento es aportar a los tomadores de decisiones en particular y a la ciudadanía en general, con base en la información actual disponible y en los procesos que se han llevado hasta este momento desde los contextos científico, político, económico y social, elementos claves para facilitar el análisis del proyecto de reglamentación del Gobierno Nacional y despejar las dudas que puedan existir en cuanto a la idoneidad y pertinencia de una regulación que asegure al mismo tiempo calidad, competencia y acceso a los medicamentos biológicos y biotecnológicos, para beneficio de los pacientes y de la salud pública.
Descarga el archivo original Medicamentos Biológicos sin Barreras
Etiqueta: biotecnológicos
Biotecnológicos: en Colombia otra vez en riesgo el acceso a medicamentos de calidad y a precio justo

El Decreto 1782 de 2014, que regula la entrada al mercado colombiano de medicamentos biotecnológicos de calidad a precios asquibles, tuvo una larga historia para ser expedido. Culminado este arduo proceso, siguió la emisión de las guías técnicas requeridas para su reglamentación, llegando finalmente a la entrada en vigencia del…
Se corrige Guía de Evaluación de Inmunogenicidad para los medicamentos biológicos

Nos complace informarles que fue publicada la Resolución 0553 de 2017, por la cual el Ministerio de Salud corrige la Guía de Evaluación de Inmunogenicidad para los medicamentos biológicos que había expedido a través de la Resolución 4490 de 2016. De esta manera, ahora si será posible materializar el paso…
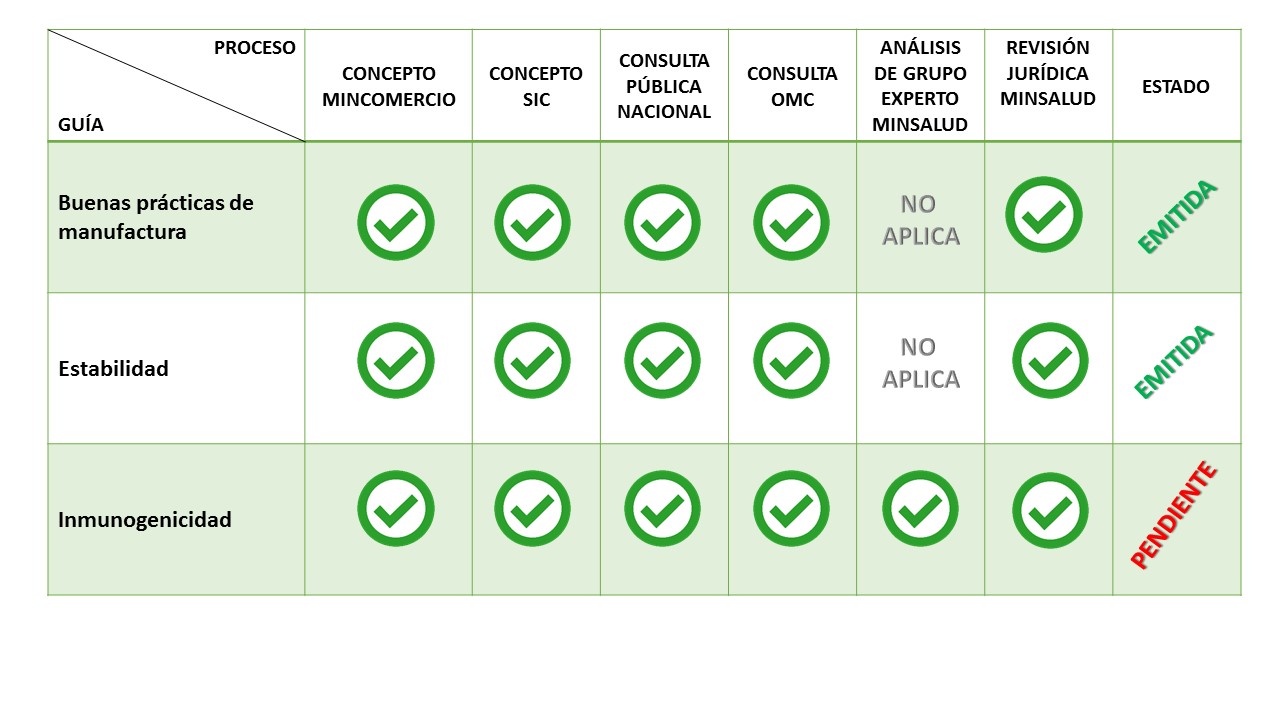
¿En qué va la reglamentación del decreto de biológicos y biotecnolígicos?
Comentarios a la Guía de Evaluación de Estabilidad de Medicamentos biológicos
Presentamos los comentarios realizados a la Guía de Evaluación de Estabilidad de Medicamentos biológicos. Desarrollados con el liderazgo técnico de la Fundación Ifarma, fueron radicados la semana pasada en el Ministerio de Salud y Protección Social en el marco del periodo para la recepción de comentarios.
Medicamentos biológicos sin barreras
Biotecnológicos: en Colombia otra vez en riesgo el acceso a medicamentos de calidad y a precio justo

El Decreto 1782 de 2014, que regula la entrada al mercado colombiano de medicamentos biotecnológicos de calidad a precios asquibles, tuvo una larga historia para ser expedido. Culminado este arduo proceso, siguió la emisión de las guías técnicas requeridas para su reglamentación, llegando finalmente a la entrada en vigencia del…
Se corrige Guía de Evaluación de Inmunogenicidad para los medicamentos biológicos

Nos complace informarles que fue publicada la Resolución 0553 de 2017, por la cual el Ministerio de Salud corrige la Guía de Evaluación de Inmunogenicidad para los medicamentos biológicos que había expedido a través de la Resolución 4490 de 2016. De esta manera, ahora si será posible materializar el paso…
¿En qué va la reglamentación del decreto de biológicos y biotecnolígicos?
Comentarios a la Guía de Evaluación de Estabilidad de Medicamentos biológicos
Presentamos los comentarios realizados a la Guía de Evaluación de Estabilidad de Medicamentos biológicos. Desarrollados con el liderazgo técnico de la Fundación Ifarma, fueron radicados la semana pasada en el Ministerio de Salud y Protección Social en el marco del periodo para la recepción de comentarios.